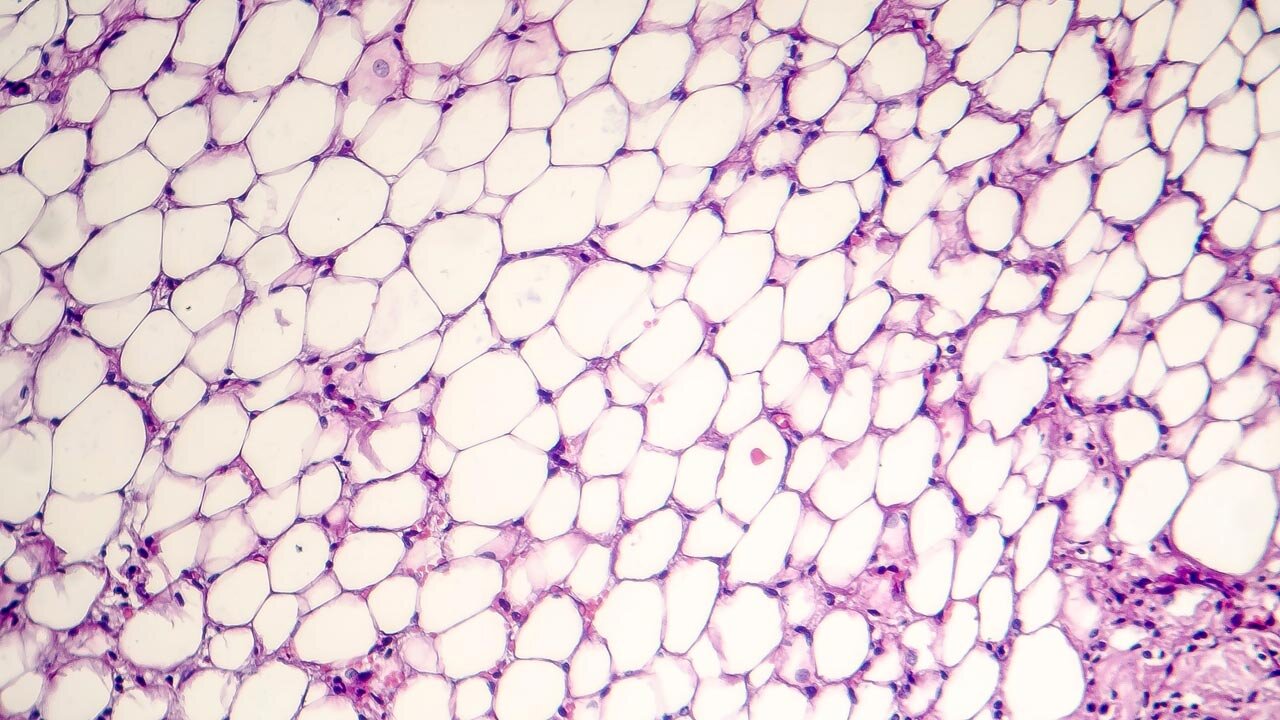
Mit zunehmendem Alter nehmen einige Menschen auch schneller an Körperfülle zu. Doch warum ist das eigentlich so? Und warum haben es manche Menschen ihr Leben lang schwer, ihr Gewicht zu halten, während andere scheinbar essen können was und so viel sie wollen, ohne dick zu werden? Diese Fragen zu klären, sind Ziele eines neuen Forschungsprojekts an der Medizinischen Fakultät der Martin-Luther-Universität Halle-Wittenberg. Die Deutsche Forschungsgemeinschaft (DFG) fördert das Projekt über drei Jahre mit 500.000 Euro.
Auch bei Stammzellen gibt es jung und alt
„In dem Projekt werden dazu junge und alte Stammzellen des Fettgewebes molekular untersucht“, sagt Dr. Juliane-Susanne Jung, die das Projekt eingeworben hat. Diese Stammzellen differenzieren sich zu neuen Fettgewebszellen und sorgen dafür, dass sich das Fettgewebe ein Leben lang regenerieren kann. Jung ist Anatomin und forscht zu alternsbezogenen Fragestellungen, einem der Forschungsschwerpunkte der Universitätsmedizin Halle (Saale) und ist seit zwei Jahren als assoziierte Nachwuchswissenschaftlerin des DFG-Graduiertenkollegs„ProMoAge“.
Beeinflusst Ernährung die Mobilisation des Speicherfetts – und wie?
„Wir vermuten, dass es vor allem Zwischenprodukte des Fettstoffwechsels sind, sogenannte Metabolite, die sich auf die Differenzierung von Fettstammzellen und die Entstehung von Adipositas im Alter begünstigend auswirken, das heißt, die Entstehung von Fettleibigkeit fördern“, so Jung. Eine wichtige Aufgabe des Fettgewebes sei es, verdaute Nahrungsfette in Form von Triglyzeriden in den Fettzellen zu speichern und bei Bedarf wieder zu mobilisieren. Dieser Prozess passiere in mehreren Teilschritten und könne im Alter verändert sein. „Inwieweit man mit bestimmten Nahrungsbestandteilen diesen Prozess beeinflussen kann, ist ein weiterer wichtiger Forschungsaspekt des DFG-Projektes“, so Jung.
Wie man Stammzellen prägt
Aus vorherigen Untersuchungen wisse man, dass Stammzellen sehr anpassungsfähig seien und eine metabolische Prägung durchlaufen können, so dass sie für eine spätere Entwicklungsphase „programmiert“ seien. Welche Metabolite und Stoffwechselwege für diese Programmierung verantwortlich seien, sei jedoch noch ungeklärt. Deswegen ist ein weiteres Ziel des Projektes, kritische Stoffwechselbedingungen und Schlüsselmoleküle zu identifizieren, um die Stammzell-„Gesundheit“ zu erhalten, eine Fehlprogrammierung zu verhindern und die Regenerationsfähigkeit der Fettgewebsstammzellen wiederherzustellen.