Osteoporose ist eine Volkskrankheit. Jede dritte Frau und jeder fünfte Mann sind mit fortschreitendem Alter von Knochenschwund betroffen. Eine häufige Folge davon ist der Oberschenkelhalsbruch – eine schmerzhafte Verletzung, die die Lebensqualität der Betroffenen massiv beeinträchtigt. Die Patienten müssen mit langfristigen Mobilitätseinbußen rechnen.
Ungleichgewicht von Auf- und Abbau
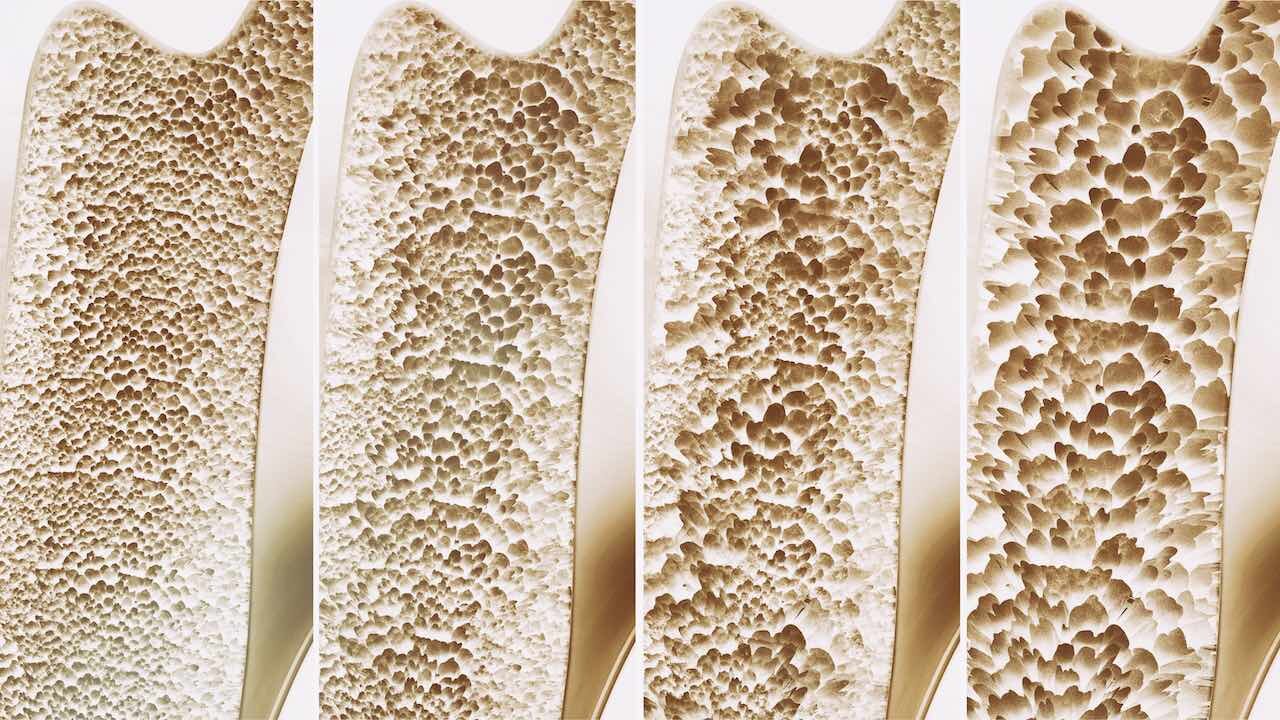
Die Krankheit bewirkt einen Schwund der Knochenmasse aufgrund eines Ungleichgewichts im natürlichen Umbauprozess im Gewebe sowie von Änderungen der Knochenqualität. Diese Änderungen betreffen die Mikrostruktur, die Dichte von Mikrorissen und Gewebeeigenschaften. Knochen haben einen äußerst komplexen Aufbau. Sägt man beispielsweise einen Oberschenkelknochen auf, erkennt man, dass er aus einer harten Außenschicht und einer porösen Füllung besteht. Unter dem Mikroskop sind innerhalb der harten Schale wiederum zylindrische Strukturen aus konzentrischen Lamellen erkennbar, die um zentrale Blutgefäße angeordnet sind. Diese einzelnen Lamellen sind nur wenige tausendstel Millimeter dick und bestehen aus einer Art natürlichem Faserverbundwerkstoff: Kollagenfasern, in die Mineralpartikel eingelagert sind, eingebettet in einer proteinhaltigen, mineralischen Matrix. Dabei gilt: Je höher die Mineralisierung, desto steifer, aber auch bruchanfälliger ist der Knochen.
Dieser hierarchische Aufbau erlaubt es den Knochen, trotz relativ geringer Dichte robust und widerstandsfähig zu sein. Wenn Knochen brechen, reicht es aber auch nicht, nur die Dichte und Struktur des Knochens auf Makroebene zu betrachten – für den Bruch sind Mechanismen in allen Skalenbereichen verantwortlich.
Werkstoffanalysen für Knochen
Eine Forschungsgruppe an der Empa in Thun unter der Leitung von Jakob Schwiedrzik will aus werkstoffkundlicher Sicht das Versagen der Knochen auf Lamellenebene besser verstehen. „Wenn man nur die Knochendichte betrachtet, wie das im klinischen Alltag heute meist der Fall ist, kann man das Bruchrisiko für Patienten im Mittel relativ gut vorhersagen. Im Einzelfall können die Resultate jedoch stark davon abweichen, und das effektive Frakturrisiko könnte falsch eingeschätzt werden.“ erklärt Schwiedrzik. „Wir hoffen, dass wir dank unserer Forschung künftig genauere Voraussagen für jeden einzelnen Patienten machen können.“ Dafür setzen die Forschenden kleinste Proben aus Knochenmaterial, die nur eine einzelne Lamelle enthalten, Zug- und Druckversuchen aus und untersuchen, wie das Material versagt und wie die gemessenen Eigenschaften mit der zugrunde liegenden Mikrostruktur zusammenhängen. Um die Strukturänderungen zu erfassen, werden die sogenannte Raman-Spektroskopie sowie Transmissionselektronenmikroskope eingesetzt.
Daten per „Machine Learning“ mit klinischem Befund korrelieren
Spannend wird es, wenn es um die Frage geht, wie sich die entwickelten Methoden für klinische Studien verwenden lassen. Dazu läuft im Moment ein Projekt, an dem Forschende des Inselspitals Bern, der Universität Bern, der ETH Zürich und der Empa beteiligt sind. Untersucht wird Knochenmaterial von Patienten, denen ein Hüftimplantat eingesetzt wurde. Dieses Material wird auf mehreren Längenskalen analysiert. Ziel ist, Daten über mikromechanische Eigenschaften, Mikrostruktur, Zellaktivität und Stoffwechsel zu sammeln und diese mittels „Machine Learning“ mit dem klinischen Befund und den Patientendaten zu korrelieren. Die so entstehende Datenbank soll es künftig erlauben, die Knochenqualität eines Patienten zu quantifizieren und mit in die Diagnose einzubeziehen.