Ein Forschungsteam des Deutschen Rheuma-Forschungszentrums Berlin (DRFZ), ein Leibniz Institut und der Charité – Universitätsmedizin Berlin, hat einen bisher unbekannten Genbereich entdeckt, der für die Regulation der körpereigenen Virusabwehr entscheidend ist, vermutlich aber auch eine große Bedeutung für Autoimmunerkrankungen hat. Diese Daten wurden nun im renommierten Wissenschaftsjournal „Nature Immunology“ veröffentlicht.
Verstärkung vieler Autoimmunerkrankungen
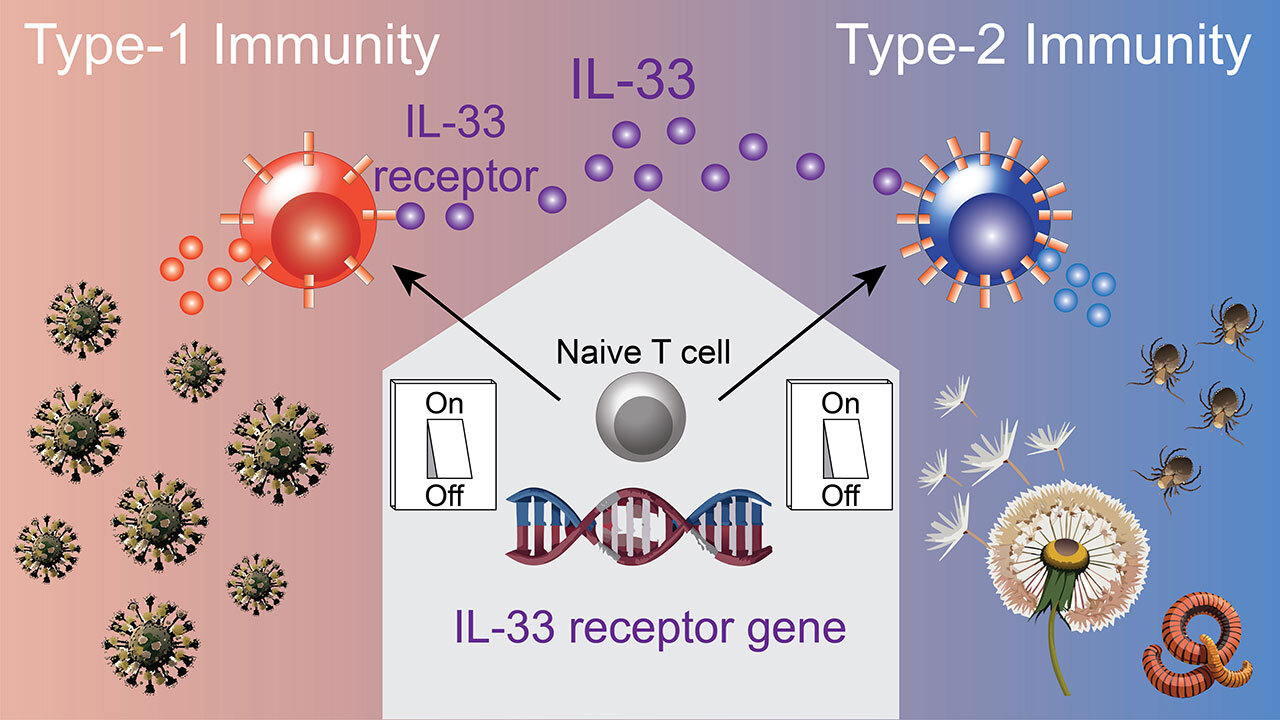
Um effektiv Viren und Krebszellen zu bekämpfen, sind Zellen der Typ-1-Immunantwort, wie zytotoxische T-Zellen oder T-Helfer-1-Zellen, essenziell. Allerdings verstärken diese Zellen auch viele Autoimmunerkrankungen. Dagegen sind Typ-2-Immunantworten für die Abwehr von Parasiten und für Heilungsprozesse von Wunden zuständig, aber sie können auch Allergien fördern.
Die Zellen der Typ-1- und Typ-2-Immunantworten brauchen körpereigene Alarmsignale, um aktiviert zu werden. Ein Beispiel für ein solches Alarmsignal ist Interleukin-33, das von absterbenden Zellen, etwa bei Infektionen, freigesetzt wird. Bisher war unklar, wie die Wahrnehmung von Interleukin-33-Alarmsignalen in Typ-1-Immunzellen reguliert wird.
Bisher unbekannten regulatorischen Genbereich identifiziert

(c) Jacqueline Hirscher, DRFZ
Dr. Tobias Brunner und Sebastian Serve, Erstautoren der Studie, vermuten: „Diese evolutionär konservierte, zelltyp-spezifische Regulation des Interleukin-33-Rezeptors ist wahrscheinlich notwendig, um zu verhindern, dass Typ-1-Immunzellen unnötig aktiviert werden und dann ungewollte Entzündungen und Autoimmunerkrankungen verursachen.“
Das Forschungsteam nutzte die CRISPR/Cas9-Genschere, um den neu identifizierten Genbereich aus dem Mauserbgut herauszuschneiden. Typ-1-Immunzellen dieser Mäuse konnten daraufhin Interleukin-33-Alarmsignale nicht mehr gut wahrnehmen, was die T-Zellantwort gegen Viren extrem schwächte. Typ-2-Immunzellen blieben dagegen unbeeinträchtigt.
Neue therapeutische Möglichkeiten eröffnet
Löhning und Brunner, Leiter der Studie, betonen: „Die Entdeckung dieses genetischen Schalters eröffnet neue therapeutische Möglichkeiten zur gezielten Beeinflussung der Aktivität von entweder Typ-1 oder Typ-2 Immunantworten, ohne die andere Form der Immunantwort gleichzeitig zu schwächen. Dies könnte helfen, maßgeschneiderte Behandlungen von ungewollten Entzündungsreaktionen zu entwickeln, wie sie etwa bei Allergien oder Autoimmunerkrankungen vorliegen“.
Publikation: